差不多下午四点,中国科学院广州生物医药与健康研究院(以下简称广州健康院)显微操作实验室一如往常。博士后王教伟透过显微镜,观察着一枚刚刚注入人类干细胞的猪胚胎。胚胎中的人类细胞在特殊光源作用下发出了耀眼的珊瑚红色。之前,这些含有红色荧光蛋白的细胞还只是普通的干细胞,经过特殊培养后,它们已经具有了极强的生存能力和分化潜能。
这些细胞被吸入到显微操作仪的注射针内,很快注入到缺失肾脏发育关键基因的猪胚胎中。24小时后,猪胚胎将被移植入选定的代孕母猪体内。28天后,这些胚胎中的一些会发育成为未成熟的人类肾脏。从动物体内“收获”人体器官不再是纸上谈兵。
9月7日,上述成果以封面论文形式发表于国际顶尖刊物《细胞干细胞》,作者来自广州健康院的多个研究团队。研究者在5个胚胎样本中观察到了人类肾脏的形成,这些肾脏处于中期肾脏的发育阶段。多位业内人士表示,该研究证明了在猪身上培养功能性人类器官的可能性,在世界范围内尚属首次。
有望解决移植器官的短缺难题
潘光锦是广州健康院研究员,也是论文的共同通讯作者。他的团队主要攻克人类干细胞在猪胚胎中生存和嵌合效率的问题。这项成果中,研究人员将人类干细胞嵌合进猪胚胎中,人-猪嵌合胚胎的肾脏中,人类细胞占比最高可达70%。在接受《中国新闻周刊》采访时,潘光锦表示,此项研究不仅是理论上重大突破,也具有未来的应用价值,在解决可移植器官短缺难题方面“具有较大的可行性”。
对很多终末期疾病患者来说,器官移植很可能是唯一有效的治疗手段。2022年,国家卫健委发布第三次《中国器官移植发展报告》。报告称,中国2015~2020年公民逝世后器官捐献累计近3万例,器官捐献、移植数两项指标居世界第二位。然而,据不完全统计,国内每年开展器官移植手术的患者达2万多例,因终末期器官功能衰竭等待移植的患者达30万,供需缺口巨大。多项研究表明,供体器官在全球范围内严重缺乏,阻碍了器官移植的临床应用。
现有研究表明,3D打印技术是一条途径,但其通常更适用于皮肤或骨骼组织的打印。西班牙国家移植组织创始人拉斐尔·马特桑斯在给《中国新闻周刊》的回复中表示,器官涉及许多不同细胞种类,拥有复杂结构,这种精细程度3D打印难以企及,他“看不到这项技术的未来”。在他眼中,不同物种间的“异种嵌合”是迄今为止最具野心、最有希望的方法,因为它能克服器官移植的两个主要障碍:器官制造和排斥反应。
王教伟是这一研究的共同第一作者,她向《中国新闻周刊》解释说,异种嵌合在学界并不新鲜,早已被认为是器官动物再生的重要途径。这种方法以大型动物为“孵化器”,用人类的细胞生长出完全属于人的组织或器官。通过该途径获得的器官理论上具有完善的结构和功能,理想状态下,用于培养器官的细胞可来自患者自己。这次广州健康院的研究,正是以器官缺陷的猪胚胎为载体,引入人类干细胞,实现了人类肾脏在猪体内的再生。
异种嵌合领域近年来成果频出。2017年,日本研究者中内启光团队通过干细胞注射方式,成功在没有胰脏的大鼠体内,长出了小鼠的胰脏,并治愈了大鼠的糖尿病。同年,时任美国索尔克研究所教授的胡安·贝尔蒙特联合吴军等人,首次观察到猪胚胎中人类干细胞的存活。2021年,贝尔蒙特再次携手中国研究团队,实现了人-猴嵌合胚胎的培养与论证。
潘光锦指出,虽然理论上种族亲缘关系越近越容易嵌合,但临床上也要考虑实用性。猪的器官大小相比猴来说,与人类更加相仿,在克隆胚胎操作、基因编辑、胚胎发育等方面都有非常大的优势。人、猴虽同属灵长类,从嵌合来讲容易,但人-猴嵌合胚胎实施难度大,无法大规模操作。作为人-猪嵌合体概念模型的奠基人之一,美国德克萨斯大学西南医学中心分子生物学系副教授吴军认为,猴子不是理想的载体。猴子一胎通常是单胞胎,只能培养一个样本,猪则可以培养多胎,更加经济效益。另外,用猴子做实验在伦理上面临更多挑战。
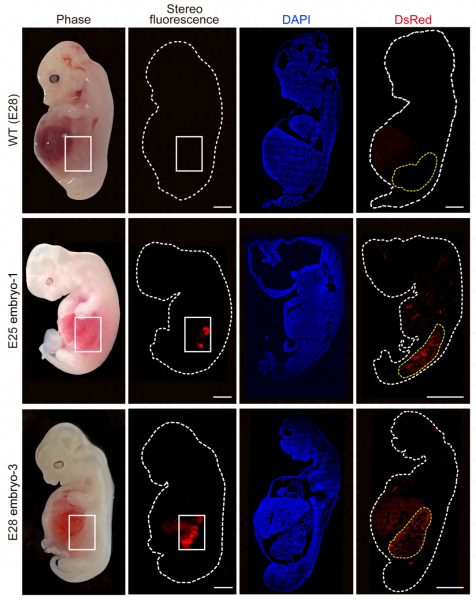
培养第25天(中)与第28天(下)嵌合胚胎内的人类肾脏细胞(红色荧光)与普通猪胚胎(上)对比。来源:广州健康院研究团队供图
吴军回忆,2017年的人-猪嵌合胚胎虽然有检测到人类细胞,但嵌合率很低,大约每10万个细胞里有一个人类细胞。此后,领域内的研究者都在追求改进人类干细胞的竞争力,使其在与人类亲缘关系较远的物种胚胎内长久存活。这次的研究能达到70%的人类细胞占比,是极其喜人的成果。
达成这一目标并非易事。潘光锦表示,最大的问题在于人、猪两种细胞之间的竞争。人类干细胞移植入猪胚胎的内部后,将面临完全不同的生长环境,例如体温、生长空间、血管和神经结构等,很容易“水土不服”。而要在这样陌生的环境里掠夺营养、保证自身生存,就更加困难。
因此,实验需要同时从基因编辑猪胚胎和干细胞培养两方面寻求突破。王教伟所在团队设计了被基因编辑过的猪胚胎,抑制其肾脏发育。这在一定程度上避免了人-猪细胞竞争,提高了肾内人类细胞比例。这是本研究与2017年首个人-猪嵌合胚胎模型的一大区别。王教伟认为,干细胞体外培养技术体系已相对成熟,难点主要在于如何保障注入的人类干细胞能在猪胚胎中分化、存活。她回忆,体外培养移植到母体前,团队对嵌合胚胎多方面检测,包括细胞存活情况、干细胞分化潜能测试、增殖数目等,也经过大量的重复实验,最终找到了合适的方法。
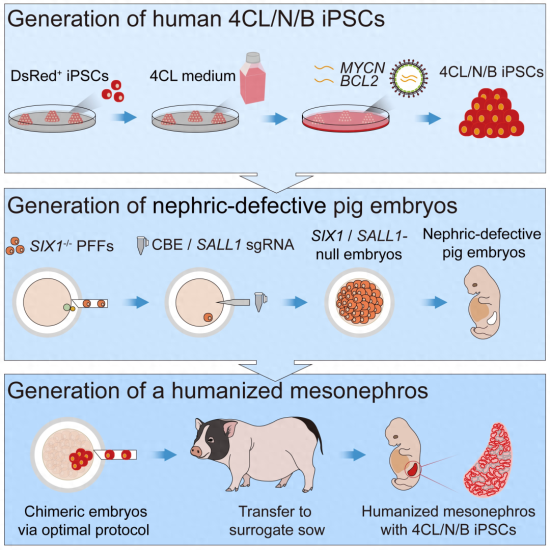
从上至下依次为人类干细胞培养、肾脏缺陷猪胚胎构建、人-猪细胞嵌合与移植 来源:广州健康院研究团队供图
潘光锦称,这次的研究证明了人-猪嵌合胚胎再造人类器官,也即胚胎补偿的路径可行。“有中肾,有很高比例的人类细胞,这就是最大的进步。”但这一研究还有更多难题要攻克。能不能得到完整的肾?这些肾脏有没有解毒功能?这都是现在无法回答的问题。王教伟解释说,人的肾脏发育分为前肾、中肾和后肾三个阶段。目前,培养至28天的胚胎处于中肾发育阶段,如果要进入下一阶段,就需要延长培养时间。这对于应用来说是必要的。
吴军认为,虽有了胚胎补偿技术,目前实验依然面临胚胎中人体细胞嵌合率低的问题。在肾脏器官没有形成前,需要有足够多的人类细胞“打入猪胚胎内部”。大众接受度是另一个可能存在的问题。研究者针对两个生存相关的基因,对人类干细胞进行了编辑。器官使用者很可能不希望使用被编辑过的细胞长成的器官。
吴军对《中国新闻周刊》说,实验获得的发育中的人类肾脏,还不是一个完整器官,之后的培养中,人类细胞占比、器官功能等指标都还是未知数。最终能否通过这种方法获得可移植人类肾脏,现在还难有定论。“目前这依然是一个偏向概念论证和理论突破的研究。”潘光锦说道。
伦理考量必要但为时过早
《细胞干细胞》今年9月的封面上,一只长着翅膀的粉色小猪在祥云间轻盈飞翔,它腰间挂着肾脏形状的信包,似乎要传递什么信号。马特桑斯称,这是人类首次利用猪作为载体培育出完整的人-猪嵌合器官。这一研究能够在25~28天阶段提取出结构正常的肾脏,确实有望成为器官再生的最佳途径。

《细胞干细胞》9月封面图 来源:广州健康院研究团队供图
然而,质疑声也不少。许多学者通过英国非营利机构《科学媒介中心》表达了对实验效率的直接质疑。英国赫特福德郡大学遗传学博士阿莱娜·潘斯指出,这一研究共植入1820个胚胎,只有5个正常胚胎被用于最后的分析。她怀疑,对细胞的基因编辑可能是造成胚胎成活率低下的原因。
潘光锦认为,人类干细胞培养有着天然的极高失败率。1998年,美国研究者詹姆斯•汤姆森分离并建立了世界上第一株人类胚胎干细胞,使其能在体外生长和增殖,并证实了人类胚胎干细胞具有高度的分化潜能,即可以分化形成任何人体细胞。如今,干细胞体外培养依然是一个难题。潘光锦曾师从汤姆森。他解释说,胚胎发育非常复杂,涉及各种组织结构间的相互调控,实验室很难精确模拟体内环境。
多位受访者认为这一实验效率是正常的。王教伟称,经过基因编辑的猪胚胎,其存活效率本身就很低,加之人类干细胞的存在,可能进一步影响部分猪胚胎发育,所以最后获得的胎儿数目就不是很多。吴军认为,胚胎发育初期还是一个没有研究透的阶段,类似“黑匣子”。
纽约大学朗格尼移植研究所免疫遗传学实验室主任马西莫·曼吉奥拉则更关注猪病毒可能传染给人类器官的问题。马特桑斯也表达了相同的担忧。2022年,美国马里兰大学的医生团队进行了全球首例猪心脏移植手术,患者戴维·贝内特接受了移植,但在术后两个月内死亡。这位猪心移植患者使用了大量免疫削弱药物,使猪心在体内存活,但他死于猪巨细胞病毒(CMV)感染。免疫力低下被认为是他死于感染的重要原因。
王教伟解释说,猪身上的病毒有外源病毒和内源病毒之分。外源病毒包括CMV,和我们平时能接触到的各种病毒一样,能够通过严格消毒来杜绝。内源病毒,特别是猪内源性逆转录病毒,目前其是否会出现跨物种传播以及传播机理尚无定论。马特桑斯在回复中指出,零风险的技术是不存在的,不能因为有病毒感染风险而放弃对嵌合体的研究。
嵌合体还可能带来伦理问题。贝尔蒙特是美国阿尔托斯实验室的科学创始人兼主任,也是世界上首屈一指的发育生物学家。他在给《中国新闻周刊》的回复中称,研究者们方法的选择非常谨慎,并遵循了这类工作的一般准则,也即在25~28天终止了实验。主要的伦理问题是人类干细胞是否会混入猪的大脑或生殖系统。他指出,研究者没有采取措施杜绝这件事的发生。
王教伟回应,对于没有空位的神经及生殖系统而言,人类细胞嵌入的可能性极小。实验对猪胚胎的大脑和生殖系统前体,即生殖嵴中的细胞进行了检测,“仅检测到极少人类细胞的存在”。论文共同通讯作者、广州健康院研究员戴祯在接受媒体采访时也表示,研究者只在大脑和脊髓中发现了很少的人类神经细胞,在生殖嵴中没有发现。
吴军表示,伦理的考量是必要的,但为时过早。人们担心人的细胞会嵌入到猪的中枢神经系统中,是害怕人类意识出现在猪脑中,而担心嵌入生殖系统,是出于种族繁殖的担忧。他认为,嵌合的多少是关键,如果这些系统和器官中的嵌合率低,其实这些担忧很可能是不必要的。关键是,这个嵌合率的临界值还远不明晰。猪的孕期为114天,而胚胎第28天并没有形成完全成熟的中枢神经系统和生殖系统。所以,至少在目前这一时期,研究者很难去量化合理的伦理约束。
吴军团队近期进行了一项研究,在小鼠脑中产生了大鼠的前脑,实现了物种之间的脑嵌合,进而可以分析其对行为、认知功能等的影响。这项成果目前以未经同行评议的预印本形式发表在学术平台bioRxiv上。潘光锦强调,伦理是认知问题。全球各国和地区对这种风险的认知都是不同的,不同学校和机构很可能允许不同的培养时间或者实验手段。科学家们要做的,则是通过技术手段来尽可能地消除伦理担忧。例如,可以探索一系列基因编辑手段,阻止人类干细胞向脑细胞或者生殖细胞方向分化。
根据2019年《自然》杂志发布的文章,当年,日本文部科学省发布新指南,对人-动物嵌合胚胎的制造和移植开了绿灯。此前,日本一直明令禁止含有人体细胞的动物胚胎生长超过14天,或将胚胎移植到代孕动物子宫中。这一“14天准则”得到包括中国在内的许多国家的长期遵守。
2021年5月,国际干细胞研究学会发布了新版指南,对“14天准则”进行了放宽,允许研究团队在所在国法律许可的前提下,向监管机构申请对14天后的胚胎继续进行研究。该指南未制定培养天数的上限。多位受访者表示,目前的“28天准则”是学界广泛认可的上限。潘光锦补充说,现在还没有允许嵌合胚胎完整发育的国家或地区,因此,伦理规范方面还没有跟上。“边做边突破”,他相信技术的发展是引领人们触碰和更新伦理边界的首要动力。